CHUVA ÁCIDA
Objetivo:
Demonstrar aos alunos como a poluição atmosférica degrada o meio ambiente, com uma
simulação de chuva ácida.
NORMAS DE SEGURANÇA:
Não inspirar os gases liberados na queima do enxofre, SO2 e SO3 , estes
são extremamente tóxicos, estes gases em contato com a água formam H2SO3 e H2SO4 ,
respectivamente. Tomar cuidado com a chama, para que não ocorra queimaduras. Caso ocorra
qualquer tipo de acidente comunique imediatamente ao professor ou ao responsável.
Tempo previsto:
30 minutos
Materiais e reagentes:
Enxofre em pó;
Água;
Pote com tampa;
Colher de chá;
Papel indicador ou repolho roxo;
Folhas ou flores;
Palitos de fósforos.
Procedimento experimental:
1. Bata uma folha de repolho roxo no liquidificador com 250 ml de água (copo de requeijão).
Encha o pote com suco do repolho roxo até 1/3 de seu volume, se usar papel indicador
amarre-o num pedaço de linha e coloque-o no frasco sem que toque a água.
2. Entorte a colher para que ela vire uma cuia e prenda-a a um pedaço de linha.
3. Coloque uma flor ou folha no suco contido no pote.
4. Com a colher torta, pegue uma pequena porção de enxofre em pó e coloque fogo nele.
Enquanto o enxofre estiver queimando, coloque a colher cuidadosamente no pote e tampeo, deixando para fora um pedaço da linha da colher.
5. Observe o ocorrido.
Questões:
1) Quais substâncias são formadas dentro do pote?
2) Qual a cor do papel indicador ou do repolho roxo? Justifique.
3) Relacione o ocorrido dentro do pote com o que acontece ao meio ambiente.
4) Por que os gases formados dentro do pote não podem ser inspirados?
5) A chuva ácida é formada apenas pelos gases vindo da queima do enxofre (SO2 e SO3)?
Condutibilidade de compostos moleculares e iônicos.
Objetivo:
Diferenciar solução iônica de uma solução molecular.
Tempo previsto:
10 minutos.
Material e reagentes:
2 bequéres de 50 mL
1 proveta de 50 mL
1 colher de medida (chá
1 lâmpada de 2,5 Volts
bateria de 9 Volts
2 fios com as pontas descascadas
sal
açúcar
água destilada
PARTE A
1. Em um béquer contendo 30 mL de água, dissolva 1 colher de chá de sal.
2. Acoplando os fios na bateria, coloque as pontas dentro da solução contendo sal. Observe o
ocorrido.
PARTE B
1. Adicione ao béquer 30 mL de água destilada.
2. Dissolva 1 colher de chá de açúcar.
3. Da mesma forma da parte A , coloque as pontas dos fios na solução. Observe o ocorrido.
MATERIAL UTILIZADO
- Buretas de 50 mL.- Suporte Universal.
- Garra de Bureta.
- Beckers de 100 e 500 mL.
- Tubos de ensaio.
- Estantes para tubo de ensaios.
- Cronômetro.
- Bico de Bünsen.
- Tela de amianto.
- Tripé de ferro.
- Termômetro de 0 a 100º C.
- Solução de ácido sulfúrico (H2SO4) 0,05 M (2,7mL/L).
- Solução de tiossulfato de sódio (Na2S2O3) 0,05 M (7,9mL/L).
PROCEDIMENTO
1 - Rotular duas buretas de 50 mL e dois beckers de 100 mL: Na2S2O3 e H2SO4.
2 - Em cada bureta colocar o líquido correspondente e sob cada uma seu respectivo becker.
3 - Em quatro tubos de ensaio, limpos e secos, nomeá-los: 1,2,3 e 4.
4 - Transferir da bureta de H2SO4 4 mL a cada um dos tubos.
5 - Em outros quatro tubos de ensaio, limpos e secos, nomeá-los: 1a,2a,3a e 4a. Repetir o passo 4 para o Na2S2O3.
6 - Colocar água no Becker de 500 mL até a metade e montar o sistema da FIGURA 1.
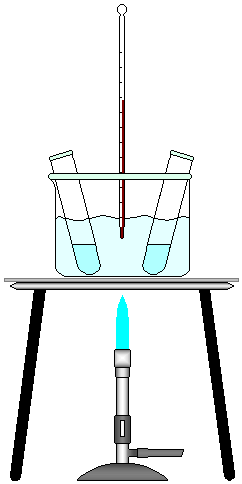
FIGURA 1 - Montagem do experimento.
8 - Esperar aproximadamente dois minutos até a temperatura dos tubos se igualarem à temperatura da água.
9 - Adicionar o conteúdo do tubo 1 no tubo 1a, mantendo este sempre imerso na água, e acionar imediatamente o cronômetro.
10 - Observar o tubo 1a até aparecer uma turvação e, então parar o cronômetro. Anotar os dados de temperatura e tempo de reação na TABELA 1.
11 - Descartar em vidro fechado o conteúdo do tubo 1a, e lavá-lo imediatamente para evitar que fique manchado.
12 - Aquecer a água em mais 10º C (aproximadamente 35º C) e colocar os tubos 2 e 2a. Repetir os passo de 8 a 11.
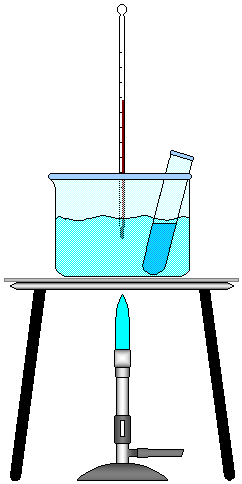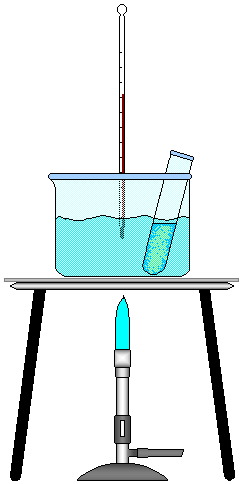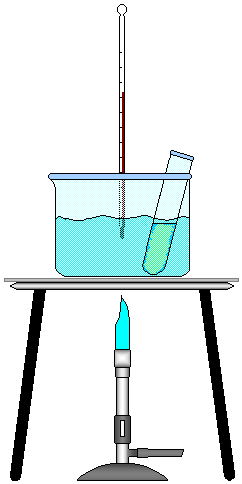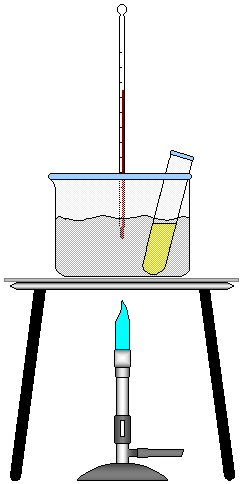
FIGURA 2 - Animação do Experimento.
14 - Para os tubos 4 e 4a, a temperatura da água deve estar 10º C mais alta (aproximadamente 60º C), colocá-los no becker e repetir os passos de 8 a11.
15 - Preencher a última coluna da TABELA 1 , fazendo V=1/t (t em segundos).
16 - Traçar um gráfico de velocidade em função da temperatura (V x T).
Tabela 1 - Temperaturas, tempos e velocidades para cada conjunto de tubos.
| TUBOS | TEMPERATURA | TEMPO | V=1/t |
| 1 e 1a | |||
| 2 e 2a | |||
| 3 e 3a | |||
| 4 e 4a |
INDICADORES ÁCIDOS-BASES NATURAIS
Objetivo:
Observar a utilização de plantas como indicadores de pH.
Descrição:
O valor do pH é um número aproximado entre 0 e 14 que indica se uma solução é ácida (pH<7),
neutra (pH=7), ou básica/alcalina (pH>7). pH é o símbolo para a grandeza físico-química 'potencial
hidrogeniônico'.Essa grandeza (potencial hidrogeniônico) é um índice que indica o grau de acidez,
neutralidade ou alcalinidade de um meio qualquer. O "p" vem do alemão potenz, que significa poder
de concentração, e o "H" é para o íon de hidrogênio (H+).O "p" equivale ao simétrico do
logaritmo(cologarítimo) de base 10 da atividade dos íons a que se refere, ou seja,
pH = - log10[H
+
]
Material:
Liquidificador;
Peneira;
Faca;
7 tubos de ensaio;
Água;
Amoníaco (NH4OH);
Soda cáustica (NaOH);
Bicarbonato de sódio (NaHCO3);
Ácido muriático (NaCl);
Suco de limão;
Espátula pequena ou colher de café;
Vinagre;
Pipeta de graduada;
Conta gotas.
Procedimento:
Corte aproximadamente 500 mililitros de repolho roxo em cubos de cerca de 2 cm e coloque num
liquidificador ou processador. Acrescente aproximadamente 250 mililitros de água e deixe bater até
que o repolho fique cortado uniformemente em pedaços minúsculos. Passe a mistura por uma peneira
fina. Esse será nosso extrato de repolho roxo para explorar ácidos e bases.
Coloque em 7 tubos de ensaio 5mL de água e 5mL de extrato de repolho.
Numere os tubos, acrescente cinco gotas dos seguintes materiais a serem testados: tubo 01-HCl, tubo
02-vinagre, tubo 03-amoníaco, tubo 04-suco de limão, tubo 05- nada; no tubo 06, coloque uma
pequena quantidade de bicarbonato com a ajuda de uma espátula; no tubo 07, coloque uma pequena
quantidade de soda cáustica também com a ajuda de espátula; Observe se houve mudança de cor e
anote.
Análise:
Algumas plantas e flores podem ser utilizadas como indicadores de pH.
Um dos mais interessantes é o extrato de repolho roxo , apresenta cores diversas conforme
a acidez e a basicidade do meio que se encontra, substituindo (para um menor número de
faixas de pH) os papéis de indicadores universais , que só podem ser adquiridos em lojas
especializadas e não são disponíveis em todas as regiões do país.
O extrato de repolho roxo mostrará cores diferentes para valores de pH diferentes. Essas
cores e os correspondentes valores (aproximados) de pH são:
pH 2 4 6 8 10 12 Acima de 12
Cor
Extrato
vermelho púrpura violeta azul Azul/verde verde amarelo
Dica:
Pode-se também utilizar outras substâncias de uso domésticos como: xampu, refrigerante, leite,
clava de ovo, álcool, açúcar, sal de cozinha (NaCl) entre outros.
VEJA MAIS:
http://www.profpc.com.br/Experimentos%20de%20Qu%C3%ADmica/experimentos.htm
Fontes: Ensino Globalizado Educação para Todos, Profpc experimentos.
Nayara 2º 4.
Nenhum comentário:
Postar um comentário