APLICAÇÕES DOS PRINCIPAIS ÁCIDOS
Ø Ácido clorídrico (HCl)
Ø Ácido clorídrico (HCl)
· O ácido impuro (técnico) é vendido no comércio com o nome de ácido muriático;

Recipiente contendo ácido muriático
· É encontrado no suco gástrico, produzido pelas células parietais, responsável pela acidez estomacal;
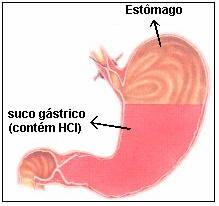
Esquema representativo do estômago contento suco gástrico (HCl)
· É um reagente muito usado na indústria e no laboratório;
· É usado na limpeza de pisos após a caiação das paredes (cal hidratada Ca(OH)2) , para remover os respingos de cal;
HCl(aq) + Ca(OH)2(s) → CaCl2(aq) + 2 H2O
Ø Ácido fluorídrico (HF)
· Tem a particularidade de corroer o vidro, devendo ser guardado em frascos de plástico, por esta razão é usado para fazer gravações sobre o vidro.
Vidro de um automóvel com gravação do número do chassi feita com HF
Ø Ácido cianídrico (HCN)· O HCN é o gás de ação venenosa mais rápida que se conhece: uma concentração de 0,3 mg por litro de ar é imediatamente mortal;
· É o gás usado nos estados americanos do Norte que adotam a pena de morte por câmara de gás;
· A primeira vítima do HCN foi seu descobridor, Carl Wihelm Scheele, que morreu ao deixar cair um vidro contendo solução de HCN.

Câmara de gás utilizado em execuções nos EUA
Ø Ácido sulfídrico (H2S)
· O H2S é um gás incolor, mais pesado do que o ar e inflamável com um forte odor desagradável de ovos podres. Esse gás é algumas vezes referido como "gás de cano de esgoto". Em pequenas concentrações ele pode irritar os olhos e atuar como depressivo; em elevadas concentrações ele pode provocar irritação do sistema respiratório superior e, durante longas exposições, edema pulmonar. Sendo mais denso que o ar, o H2S pode acumular-se em depressões e cavernas.

Aquecendo as mãos no geiser (deserto chileno nos andes) que elimina H2S com odor de ovo podre.
Ø Ácido sulfúrico (H2SO4)
· É o ácido mais utilizado e importante nas indústrias e nos laboratórios, conhecido como “burro de carga”. O poder econômico de um país pode ser avaliado pela quantidade de ácido sulfúrico que ele fabrica e consome;
· O maior consumo de ácido sulfúrico é na fabricação de fertilizantes, como os superfosfatos e o sulfato de amônio;
· É o ácido dos acumuladores de chumbo (baterias) usados nos automóveis;

Bateria automotiva contendo solução de H2SO4
· O ácido sulfúrico concentrado é um dos desidratantes mais enérgicos. Assim, ele carboniza os hidratos de carbono como os açúcares, amido e celulose; a carbonização é devido à desidratação desses materiais;
C12H22O11(s)  12 C(s) + 11 H2O(v)
12 C(s) + 11 H2O(v)
Sacarose Carvão
Adicão de ác. sulfúrico ao açúcar com desidratação e formação de carvão com expansão de massa.
· O ácido sulfúrico "destrói" o papel, o tecido de algodão, a madeira, o açúcar e outros materiais devido à sua enérgica ação desidratante;· O ácido sulfúrico concentrado tem ação corrosiva sobre os tecidos dos organismos vivos também devido à sua ação desidratante. Produz sérias queimaduras na pele. Por isso, é necessário extremo cuidado ao manusear esse ácido;
· As chuvas ácidas em ambiente poluídos com dióxido de enxofre contêm H2SO4 e causam grande impacto ambiental.
S + O2(g) → SO2(g) + 1/2 O2(g) → SO3(g) + H2O(l) → H2SO4(aq)
impureza ar ar água da chuva chuva ácida
dos derivados
do petróleo



Efeitos da chuva ácida: estátua antes e depois da exposição à chuva ácida, floresta negra na Alemanha em 1970 e 1983 depois da exposição à chuva ácida.
Ø Ácido nítrico (HNO3)
· Depois do sulfúrico, é o ácido mais fabricado e mais consumido na indústria. Seu maior consumo é na fabricação de explosivos, como nitroglicerina (dinamite), trinitrotolueno (TNT), trinitrocelulose (algodão pólvora) e ácido pícrico e picrato de amônio;
· É usado na fabricação do salitre (NaNO3, KNO3) e da pólvora negra (salitre + carvão + enxofre);
Pólvora negra: (Salitre - KNO3 + Carvão - C + Enxofre - S)
N2(g) + O2(g) → 2 NO(g) + O2(g) → 2 NO2(g) + H2O(l) → HNO2 + HNO3

Explosão realizada através do uso do TNT obtido a partir do HNO3
Ø Ácido fosfórico (H3PO4)
· Os seus sais (fosfatos) têm grande aplicação como fertilizantes na agricultura;
· É usado como aditivo (acidulante) em refrigerantes como Coca-Cola.

Refrigerante contendo H3PO4 como acidulante
Ø Ácido carbônico (H2CO3)
· É o ácido das águas minerais gaseificadas e dos refrigerantes. Forma-se na reação do gás carbônico com a água: CO2 + H2O à H2CO3
· Responsável pelo processo de formação da chuva ácida em ambientes não poluídos na ausência de descargas elétricas.
CO2(g) + H2O(l) Û H2CO3(aq) Û H+(aq) + HCO31-(aq)


Bebidas contendo ácido carbônico (H2CO3)
Ø Ácido acético (H3C-COOH)
· É o ácido constituinte do vinagre, utilizado com condimento na culinária;
· O vinagre é uma solução aquosa contendo de 3 a 7% de ácido acético.
Vinagre contendo 3% a 7% de ácido acético
APLICAÇÕES DAS PRINCIPAIS BASES
Ø Hidróxido de sódio – NaOH
· Base conhecida como “soda cáustica” ou “lixívia” ou "diabo verde". É a base mais importante da indústria e do laboratório. É fabricado e consumido em grandes quantidades;
· Utilizado em produtos para desentupir ralos, pias e limpa forno;


no desentupimento de ralos
· É usado na fabricação do sabão. Atualmente, o sabão é obtido de gorduras (de boi, de porco, de carneiro, etc) ou de óleos (de algodão, de vários tipo de palmeiras, etc.). A hidrólise alcalina de glicerídeos (óleos ou gorduras) é denominada, genericamente, de reação de saponificação porque, numa reação desse tipo, quando é utilizado um éster proveniente de um ácido graxo, o sal formado recebe o nome de sabão. A equação abaixo representa genericamente a hidrólise alcalina de um óleo ou de uma gordura:
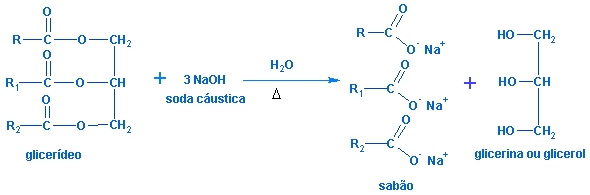

sabão obtido pela reação da soda cáustica com óleo ou gordura
· É usado em inúmeros processos industriais na petroquímica e na fabricação de papel, celulose, corantes, etc. É muito corrosivo e exige muito cuidado ao ser manuseado.
· Não existe soda cáustica livre na natureza, é fabricado por eletrólise (decomposição por corrente elétrica) de solução aquosa de sal de cozinha (NaCl).
Ø Hidróxido de cálcio – Ca(OH)2
· Conhecido como cal hidratada ou cal extinta ou cal apagada;
· É utilizado na construção civil no preparo da argamassa, usada na alvenaria, e na caiação (pintura a cal) o que fazem os pedreiros ao preparar a argamassa.


cal hidratada utilizada na preparação da argamassa
Ø Hidróxido de magnésio – Mg(OH)2
· È um sólido branco muito pouco solúvel em água;
· Quando disperso em água, origina um líquido espesso, denominado desuspensão, que contém partículas sólidas misturadas à água denominado deleite de magnésia utilizado como laxante e antiácido.
2 HCl(aq) + Mg(OH)2(aq) → MgCl2(aq) + 2 H2O(l)
acidez estomacal antiácido


suspensão de hidróxido de magnésio denominado de leite de magnésia
Ø Hidróxido de alumínio – Al(OH)3
· É um sólido gelatinoso insolúvel na água;
· Utilizado no tratamento da água. O hidróxido de alumínio formado na superfície, como um precipitado gelatinoso, arrasta as impurezas sólidas para o fundo do tanque, no processo denominado decantação;
Al2(SO4)3 + 3 Ca(HCO3)2 → 2 Al(OH)3 + 3 CaSO4 + 6 CO2


Tanques de decantação onde os flocos (hidróxido de alumínio + impurezas) depositam-se no fundo formando uma camada de lodo
· Utilizado como medicamento com ação de antiácido estomacal (Pepsamar, Natusgel, Gelmax, etc) pois neutraliza o excesso de HCl no suco gástrico.
3 HCl(aq) + Al(OH)3(aq) → AlCl3(aq) + 3 H2O(l)
acidez estomacal antiácido

Pepasamar – medicamento utilizado como antiácido estomacal
Ø Hidróxido de amônio – NH4OH
· É obtido através do borbulhamento de amônia(NH3) em água, originando uma solução conhecida comercialmente como amoníaco;
NH3(g) + H2O(l) 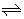 NH4OH(aq)
NH4OH(aq) 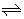 NH4+(aq) + OH-(aq)
NH4+(aq) + OH-(aq)
amônia amoníaco íon amônio íon hidróxido
· É utilizado em produtos de limpeza doméstica tais como: ajax, fúria, pato, veja, etc.

produtos contendo amônia dissolvida em água
· É utilizado na fabricação de sais de amônio, empregados na agricultura e como explosivos.

Indústria em Mejillones (Chile) que fabrica nitrato de amônio utilizado como explosivo.
APLICAÇÕES DE ALGUNS ÓXIDOS
Ø Peróxido de hidrogênio – H2O2
· Conhecido comercialmente como água oxigenada (solução aquosa);

água oxigenada (solução aquosa de peróxido de hidrogênio)
· A solução aquosa de peróxido de hidrogênio (água oxigenada) possui concentração de oxigênio liberado por unidade de volume da solução. Assim, se 1 mL (ou 1 litro) de uma solução de água oxigenada é capaz de liberar 10 mL (ou 10 litros) de oxigênio nas condições normais de temperatura e pressão (CNTP), diz-se que se trata de água oxigenada 10 volumes.
· Utilizado na desinfecções de feridas (água oxigenada 5 ou 10 volumes), como alvejante de cabelos (água oxigenada 20 volumes), agente de branqueamento e desodorização de tecidos, etc.
· Quando se faz a limpeza (desinfecção) de um ferimento com água oxigenada, no local surgem bolhas, provenientes da decomposição do H2O2:
H2O2(aq) → H2O(l) + ½ O2(g)
O O2(g) produzido é o responsável pelas bolhas produzidas que mata as bactérias anaeróbicas, ou seja, que não sobrevivem na presença do oxigênio.
Ø Óxido de cálcio – CaO
· Conhecido comercialmente como cal viva ou cal virgem;
· Obtido a partir da decomposição por aquecimento do calcário:
CaCO3(s) 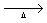 CaO(s) + CO2(g)
CaO(s) + CO2(g)
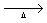 CaO(s) + CO2(g)
CaO(s) + CO2(g)
· O óxido de cálcio possui propriedades alcalinas, pois ao ser adicionado em água, produz uma base (hidróxido de cálcio):
CaO(s) + H2O(l) → Ca(OH)2(aq)
· Utilizado na construção civil no preparo da argamassa e também adicionado ao solo para diminuir a acidez.

Calagem: adição de cal ao solo para reduzir a acidez.
Ø Óxido de magnésio – MgO
· Conhecido comercialmente como magnesia;
· Obtido por queima do magnésio ao ar. Reação do princípio de funcionamento do flash fotográfico:
Mg(s) + ½ O2(g) → MgO(s)

Flash fotográfico constituído por magnésio que ao queimar produz MgO.
· O óxido de magnésio possui propriedades alcalinas, pois ao ser adicionado em água, produz uma base (hidróxido de magnésio) utilizado como antiácido estomacal:
MgO(s) + H2O(l) → Mg(OH)2(aq)
Ø Óxido de silício – SiO2
· Conhecido comercialmente como sílica ou cristal de rocha;
· É o constituinte químico da areia, considerado o óxido mais abundante da crosta terrestre. Apresenta-se nas variedades de quartzo, ametista, ágata, ônix, opala, etc;

Dunas de areia constituídas por óxido de silício.
· Utilizado na fabricação do vidro, porcelana, tijolos refratários para fornos, argamassa, lixas, fósforos, saponáceos, etc.
Ø Óxido de alumínio – Al2O3
· Constitui o minério conhecido como bauxita (Al2O3.2H2O) ou alumina(Al2O3);

Minério bauxita (obtenção de alumínio).
· Utilizado na obtenção do alumínio e como pedras preciosas em joalherias (rubi, safira, esmeralda, topázio, turquesa, etc.).
Ø Dióxido de carbono – CO2
· Conhecido gás carbônico;
· É um gás incolor, inodoro, mais denso que o ar. Não é combustível e nem comburente, por isso, é usado como extintor de incêndio;

Ao ser acionado o extintor, o gás é liberado formando uma nuvem que ABAFA e RESFRIA o fogo.
· O CO2 é o gás usado nos refrigerantes e nas águas minerais gaseificadas. O gás carbônico é um óxido de característica ácida, pois ao reagir com a água produz ácido carbônico:
CO2 + H2O H2CO3 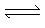 H+ + HCO3-
H+ + HCO3-
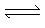 H+ + HCO3-
H+ + HCO3-
Esta reação explica o caráter ácido da chuva em ambientes não poluídos. O gás carbônico do ar reage com a água da chuva, formando ácido carbônico. Esta chuva ácida não causa nenhum dano ao meio ambiente (animais e vegetais) pois forma um ácido fraco e instável.
· O CO2 sólido, conhecido por gelo seco, é usado para produzir baixas temperaturas, em extintores de incêndio e efeitos especiais em shows;

Efeitos especiais produzidos pelo gás carbônico solidificado (gelo seco).
· O CO2 não é tóxico, por isso não é poluente, porém uma alta concentração de gás carbônico na atmosfera causa o chamado efeito estufa.
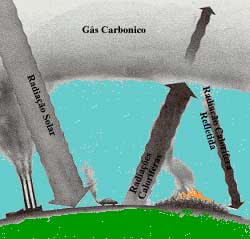
Efeito estufa causado pelo excesso de gás carbônico na atmosfera.
Nayara, Thiago, Iziane 2º 4

Nenhum comentário:
Postar um comentário