Os óxidos são compostos muito comuns que estão presentes em nosso cotidiano são compostos binários, ou seja,formados por apenas dois elementos químicos, em que o oxigênio é o elemento mais eletronegativo, o único elemento mais eletronegativo que o oxigênio é o flúor; por tanto, flúor, quando combinado com o oxigênio, não forma óxidos . Veja alguns exemplos:

A água (H2O) é um óxido vital para nossa sobrevivência.
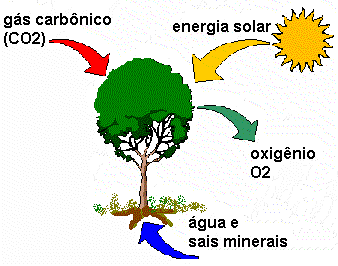
O gás carbônico (CO2) é um óxido considerado como a base da vida dos vegetais e dos animais que deles se alimentam, pois participa do processo de fotossíntese.

A ferrugem que corrói os objetos de ferro é nada mais que uma variedade de óxido de ferro (Fe2O3) formado pela reação do ferro com o oxigênio do ar.
A quase totalidade dos metais que são utilizados no nosso dia a dia é obtida, por processos de separação, a partir de minérios. Grande parte desses minérios é constituída por óxidos:

Bauxita: óxido de alumínio (A2O3)

Hematita: óxido de ferro (Fe2O3)
No entanto, muitos óxidos produzidos por alguns processos de industrialização através da queima dos combustíveis, são substâncias nocivas, considerados como poluentes atmosféricos, que podem causar vários danos ao ambiente.


Óxidos produzidos pelas chaminés das indústrias que causam danos ao meio ambiente

Na queima dos combustíveis ocorre eliminação de óxidos pelo escape dos veículos que causam grande impacto ambiental.

Efeito produzido na atmosfera por decorrência da poluição causada por substâncias nocivas, dentre as quais citam-se os óxidos de nitrogênio, carbono e enxofre.
DEFINIÇÃO E FORMULAÇÃO DOS ÓXIDOS
 De acordo com tal definição, os óxidos são formulados da seguinte forma:
De acordo com tal definição, os óxidos são formulados da seguinte forma: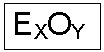
Onde: E à representa o elemento ligado ao oxigênio que pode ser um metal ou um ametal;
O à representa o elemento oxigênio com carga – 2;
X à indica o número de átomos do elemento ligado ao oxigênio;
Y à indica o número de átomos de oxigênio da fórmula do óxido.
NOMENCLATURA
1º) Para óxidos do tipo: EXOY, onde o elemento E é um ametal.
Prefixo que indica a quantidade de oxigênio (Y)
Mono, di, tri, tetra, penta, etc.
|
Óxido de
|
Prefixo que indica a quantidade do outro elemento (X)
Di, tri, tetra
|
Nome do elemento
|
Exemplos:
CO → monóxido de carbono
CO2 → dióxido de carbono
NO2 → dióxido de nitrogênio
N2O → monóxido de dinitrogênio
N2O3 → trióxido de dinitrogênio
2º) Para óxidos do tipo: EXOY, onde o elemento E é um metal com a carga fixa.

Metais com carga fixa:
→ Metais alcalinos (1A) e Ag = +1
→ Metais alcalinos terrosos (2A) e Zn = +2
→ Alumínio = +3
Exemplo:
Na2O → óxido de sódio
CaO → óxido de cálcio
Al2O3 → óxido de alumínio
K2O → óxido de potássio
MgO → óxido de magnésio
Para montar a fórmula do óxido a partir do nome, é só lembrar a carga do metal, a carga do oxigênio -2 e fazer com que a soma das cargas se anule.
Exemplos:
Óxido de lítio → Li1+O2- invertendo as cargas: Li2O
Óxido de bário → Ba2+O2-, como a soma das cargas é nula, então temos: BaO
Óxido de alumínio → Al3+O2-, invertendo as cargas: Al2O3
Óxido de zinco → Zn2+O2-, como a soma das cargas é nula, então temos: ZnO
Óxido de prata → Ag1+O2-, invertendo as cargas: Ag2O3º) Para óxidos do tipo: EXOY, onde o elemento E é um metal com a carga variável.

ou ainda:
Metais com carga variável:
→ Ouro (Au1+ e Au3+)
→ Cobre (Cu1+ e Cu2+)
→ Ferro (Fe2+ e Fe3+)
→ Chumbo (Pb2+ e Pb4+)
Exemplos:
Au2O3 → óxido de ouro-III ou aúrico
Cu2O → óxido de cobre-I ou cuproso
Fe2O3 → óxido de ferro-III ou férrico
PbO2 → óxido de chumbo-IV ou plúmbico
CLASSIFICAÇÃO DOS ÓXIDOS
ÓXIDOS ÁCIDOS OU ANIDRIDOS
São óxidos moleculares que reagem com a água, produzindo um ácido, ou reagem com uma base, produzindo sal e água.
Os óxidos ácidos, como são obtidos a partir dos ácidos, pela retirada de água, são denominados de anidridos de ácidos.
Exemplos:
H2SO4 - H2O = SO3 (anidrido sulfúrico)
H2SO3 - H2O = SO2 (anidrido sulfuroso)
H2CO3 - H2O = CO2 (anidrido carbônico)
HNO3 + HNO3 = H2N2O6 - H2O = N2O5 (anidrido nítrico)
HNO2 + HNO2 = H2N2O4 - H2O = N2O3 (anidrido nitroso)
H3PO4 + H3PO4 = H6P2O8 - 3 H2O = P2O5 (anidrido fosfórico)
REAÇÕES
CO2 + H2O →
CO2 + NaOH →
1º) Equacionar a reação do óxido com água:
CO2 + H2O → H2CO3
2º) Equacionar a reação do ácido produzido na reação anterior com a base:
H2CO3 + 2 NaOH → Na2CO3 + 2 H2O
Somando as duas equações ficamos com:
CO2 + 2 NaOH → Na2CO3 + 2 H2O
ÓXIDOS BÁSICOS
São óxidos iônicos de metais alcalinos e metais alcalinos terrosos, que reagem com água, produzindo uma base, ou reagem com um ácido, produzindo sal e água.
CaO + H2O →
CaO + H3PO4 →
1º) Equacionar a reação do óxido com água:
3 CaO + 3 H2O → 3 Ca(OH)2
2º) Equacionar a reação da base produzida na reação anterior com o ácido:
3 Ca(OH)2 + 2 H3PO4 → Ca3(PO4)2 + 6 H2O
Somando as duas equações ficamos com:
3 CaO + 2 H3PO4 → Ca3(PO4)2 + 3 H2O
ÓXIDOS ANFÓTEROS
São óxidos que podem se comportar ora como óxido básico, ora como óxido ácido.
Exemplos: ZnO, Al2O3, SnO, SnO2, PbO e PbO2.
ZnO + 2HCl → ZnCl2 + H2O
ZnO + 2NaOH → Na2ZnO2 + H2O
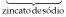
ÓXIDOS NEUTROS OU INDIFERENTES
São óxidos que não reagem com água, base ou ácido.
São basicamente três óxidos: CO, NO, N2O.
ÓXIDOS DUPLOS OU MISTOS
Óxidos que se comportam como se fossem formados por dois outros óxidos, do mesmo elemento químico.
Exemplos:
Fe3O4 → FeO . Fe2O3
Pb3O4 → 2PbO . PbO2
PERÓXIDOS
Os peróxidos são formados pelos elementos hidrogênio, metais alcalinos e alcalino-terrosos, sendo apenas o H2O2 molecular e os demais iônicos.
H2O2 → peróxido de hidrogênio (água oxigenada)
Na2O2 → peróxido de sódio
CaO2 → peróxido de cálcio
Os peróxidos que reagem com:
– água, produzindo base e peróxido de hidrogênio;
– ácido, produzindo sal e peróxido de hidrogênio.
Exemplo:
Na2O2 + H2O →
Na2O2 + H2SO4 →
1º) Equacionar a reação do peróxido com água:
Na2O2 + 2 H2O → 2 NaOH + H2O2 (H2O + 1/2 O2)
Na2O2 + H2O → 2 NaOH + 1/2 O2
2º) Equacionar a reação da base produzida na reação anterior com o ácido:
2 NaOH + H2SO4 → Na2SO4 + 2 H2O
Somando as duas equações ficamos com:
Na2O2 + H2SO4 → Na2SO4 + H2O + 1/2 O2
SUPERÓXIDOS
Os superóxidos são óxidos iônicos que possuem valência -1/2. São formados pelos metais alcalinos e alcalino-terrosos.
A nomenclatura de um superóxido é semelhante à dos óxidos, bastando substituir a palavra óxido por superóxido:
Na2O4 ou NaO2 → superóxido de sódio
CaO4 → superóxido de cálcio
Os superóxidos que reagem com:
– água, produzindo base, peróxido de hidrogênio e oxigênio;
– ácido, produzindo sal, peróxido de hidrogênio e oxigênio.
Exemplo:
K2O4 + H2O →
K2O4 + H2SO4 →
1º) Equacionar a reação do peróxido com água:
K2O4 + 2 H2O → 2 KOH + H2O2 + O2
2º) Equacionar a reação da base produzida na reação anterior com o ácido:
2 KOH + H2SO4 → K2SO4 + 2 H2O
Somando as duas equações ficamos com:
K2O4 + H2SO4 → K2SO4 + H2O2 + O2
APLICAÇÕES DE ALGUNS ÓXIDOS NO COTIDIANO
Ø Peróxido de hidrogênio – H2O2
· Conhecido comercialmente como água oxigenada (solução aquosa);

água oxigenada (solução aquosa de peróxido de hidrogênio)
· A solução aquosa de peróxido de hidrogênio (água oxigenada) possui concentração de oxigênio liberado por unidade de volume da solução. Assim, se 1 mL (ou 1 litro) de uma solução de água oxigenada é capaz de liberar 10 mL (ou 10 litros) de oxigênio nas condições normais de temperatura e pressão (CNTP), diz-se que se trata de água oxigenada 10 volumes.
· Utilizado na desinfecções de feridas (água oxigenada 5 ou 10 volumes), como alvejante de cabelos (água oxigenada 20 volumes), agente de branqueamento e desodorização de tecidos, etc.
· Quando se faz a limpeza (desinfecção) de um ferimento com água oxigenada, no local surgem bolhas, provenientes da decomposição do H2O2:
H2O2(aq) → H2O(l) + ½ O2(g)
O O2(g) produzido é o responsável pelas bolhas produzidas que mata as bactérias anaeróbicas, ou seja, que não sobrevivem na presença do oxigênio.
Ø Óxido de cálcio – CaO
· Conhecido comercialmente como cal viva ou cal virgem;
· Obtido a partir da decomposição por aquecimento do calcário:
CaCO3(s) 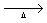 CaO(s) + CO2(g)
CaO(s) + CO2(g)
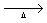 CaO(s) + CO2(g)
CaO(s) + CO2(g)
· O óxido de cálcio possui propriedades alcalinas, pois ao ser adicionado em água, produz uma base (hidróxido de cálcio):
CaO(s) + H2O(l) → Ca(OH)2(aq)
· Utilizado na construção civil no preparo da argamassa e também adicionado ao solo para diminuir a acidez.

Calagem: adição de cal ao solo para reduzir a acidez.
Ø Óxido de magnésio – MgO
· Conhecido comercialmente como magnesia;
· Obtido por queima do magnésio ao ar. Reação do princípio de funcionamento do flash fotográfico:
Mg(s) + ½ O2(g) → MgO(s)

Flash fotográfico constituído por magnésio que ao queimar produz MgO.
· O óxido de magnésio possui propriedades alcalinas, pois ao ser adicionado em água, produz uma base (hidróxido de magnésio) utilizado como antiácido estomacal:
MgO(s) + H2O(l) → Mg(OH)2(aq)
Ø Óxido de silício – SiO2
· Conhecido comercialmente como sílica ou cristal de rocha;
· É o constituinte químico da areia, considerado o óxido mais abundante da crosta terrestre. Apresenta-se nas variedades de quartzo, ametista, ágata, ônix, opala, etc;

Dunas de areia constituídas por óxido de silício.
· Utilizado na fabricação do vidro, porcelana, tijolos refratários para fornos, argamassa, lixas, fósforos, saponáceos, etc.
Ø Óxido de alumínio – Al2O3
· Constitui o minério conhecido como bauxita (Al2O3.2H2O) ou alumina(Al2O3);

Minério bauxita (obtenção de alumínio).
· Utilizado na obtenção do alumínio e como pedras preciosas em joalherias (rubi, safira, esmeralda, topázio, turquesa, etc.).
Ø Dióxido de carbono – CO2
· Conhecido gás carbônico;
· É um gás incolor, inodoro, mais denso que o ar. Não é combustível e nem comburente, por isso, é usado como extintor de incêndio;

Ao ser acionado o extintor, o gás é liberado formando uma nuvem que ABAFA e RESFRIA o fogo.
· O CO2 é o gás usado nos refrigerantes e nas águas minerais gaseificadas. O gás carbônico é um óxido de característica ácida, pois ao reagir com a água produz ácido carbônico:
CO2 + H2O H2CO3 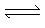 H+ + HCO3-
H+ + HCO3-
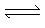 H+ + HCO3-
H+ + HCO3-
Esta reação explica o caráter ácido da chuva em ambientes não poluídos. O gás carbônico do ar reage com a água da chuva, formando ácido carbônico. Esta chuva ácida não causa nenhum dano ao meio ambiente (animais e vegetais) pois forma um ácido fraco e instável.
· O CO2 sólido, conhecido por gelo seco, é usado para produzir baixas temperaturas, em extintores de incêndio e efeitos especiais em shows;

Efeitos especiais produzidos pelo gás carbônico solidificado (gelo seco).
· O CO2 não é tóxico, por isso não é poluente, porém uma alta concentração de gás carbônico na atmosfera causa o chamado efeito estufa.
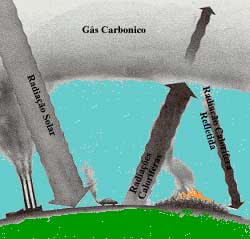
Efeito estufa causado pelo excesso de gás carbônico na atmosfera.
Ø Monóxido de carbono – CO
· É um gás incolor extremamente tóxico por inalação, pois se combina com a hemoglobina do sangue, impedindo o transporte de oxigênio às células e aos tecidos, causando hipoxia;
· É considerado um gás inerte, ou seja, não reage com a água, soluções ácidas e soluções básicas;
· É Combustível, ou seja, reage com o oxigênio. Forma-se na queima incompleta de combustíveis como álcool (etanol), gasolina, óleo, diesel, etc;
· A quantidade de CO lançada na atmosfera pelo escapamento dos automóveis, caminhões, ônibus, etc. cresce na seguinte ordem em relação ao combustível usado: álcool < gasolina < óleo diesel. A gasolina usada como combustível contém um certo teor de álcool (etanol), para reduzir a quantidade de CO lançada na atmosfera e, com isso, diminuir a poluição do ar, ou seja, diminuir o impacto ambiental.
Ø Dióxido de enxofe (SO2) e trióxido de enxofre (SO3)
· São óxidos eliminados dos escamentos dos veículos movidos a derivados do petróleo (óleo diesel, querosene e gasolina) que possuem enxofre como impureza:
S(s) + O2(g) → SO2(g)
O enxofre (impureza dos derivados do petróleo) é queimado na câmara de explosão do motor, lançando SO2(g) através do escamento na atmosfera.
SO2(g) + ½ O2(g) → SO3(g)
O dióxido de enxofre liberado, reage com o oxigênio do ar, produzindo o trióxido de enxofre (SO3).
Observação: O álcool (etanol) não contém enxofre como impureza e, por isso, na sua queima não é liberado o SO2. Esta é mais uma vantagem do álcool em relação à gasolina em termos de poluição atmosférica.
· São óxidos de característica ácida, pois reagem com água formando ácidos:
SO2(g) + H2O(l) → H2SO3(aq)
SO3(g) + H2O(l) → H2SO4(aq)
Neste caso, o SO2(g) e SO3(g) eliminados dos escamentos dos veículos, em contato com a água da chuva causa a chamada chuva ácida.
ÓXIDOS DE NITROGÊNIO
Ø Dióxido de nitrogênio (NO2)
· É um gás de cor castanho-avermelhada, de cheiro forte e irritante, muito tóxico;
· Nos motores de explosão dos automóveis, caminhões, etc., devido à temperatura muito elevada, o nitrogênio e oxigênio do ar se combinam resultando em óxidos do nitrogênio, NO e NO2, que poluem a atmosfera:
N2(g) + O2(g) → 2 NO(g)
NO(g) + ½ O2(g) → NO2(g)
· O NO2(g) é um óxido de característica ácida, pois ao reagir com a água, forma uma solução ácida:

Chuva ácida em ambientes não poluídos na presença de raios e relâmpagos.
2 NO2(g) + H2O(l) → HNO3(aq) + HNO2(aq)
Neste caso, o NO2 produzido, entra em contato com a água da chuva causando também a chuva ácida.
· O NO2 produzido na queima dos combustíveis, reage com o O2 do ar produzindo O3 (ozônio), que é outro sério poluente atmosférico:
NO2(g) + O2(g) → NO(g) + O3(g)
O ozônio produzido é extremamente tóxico, causando inflamações nas vias respiratórias quando inalado.
Ø Monóxido de dinitrogênio (N2O)
· É conhecido como óxido nitroso ou gás hilariante;
· O óxido nitroso é um gás incolor, sem cheiro, não combustível, considerado um óxido neutro, ou seja, não reage com água, solução ácida e solução básica;
· Inspirado por alguns instantes, o N2O produz uma espécie de embriaguez agradável, acompanhada de insensibilidade e às vezes de um riso espasmódico, o que lhe valeu a denominação de gás hilariante;
· Utilizado em Medicina como anestésico fraco que pode ser utilizado em cirurgias rápidas, pois sua inalação prolongada e repetida pode causar problemas sérios. Além disso, tem a propriedade de causar euforia;

Óxido nitroso – “gás hilariante”
· Em função da baixa toxicidade, o N2O é usado hoje como agente formador de espumas em cremes. Para isso, ele é colocado nas embalagens, sob pressão, junto com o creme. Ao acionar a válvula de liberação, a diferença entre a pressão interna e a do ambiente faz o gás se expandir, e nessa expansão o creme se transforma em espuma. Os cremes podem ser de vários tipos, inclusive alimentícios;
· Outro uso bastante conhecido do gás hilariante está na fabricação de granadas usadas por forças policiais para reprimir desordens e manifestações civis. Seu efeito é mais o de assustar as pessoas que o de causar lesões. As granadas contendo óxido nitroso líquido são usadas para esse fim porque o gás hilariante que liberam provoca sonolência e perturbações motoras, durante alguns minutos, naqueles que o inalam.
Ø Monóxido de nitrogênio (NO)
· É conhecido como óxido nítrico;
· O óxido nítrico é um gás incolor sem cheiro, considerado um óxido neutro, ou seja, não reage com água, solução ácida e solução básica;
· É uma substância considerada como uma “faca de dois gumes”, ou seja, pode ser benéfica ou potencialmente tóxica conforme a concentração e a forma de disponibilização;
· Formado na atmosfera pela oxidação incompleta do nitrogênio do ar nas combustões em alta temperatura, como em fornos industriais, motores e turbinas a jatos. Altamente tóxico, provoca irritação nas mucosas e pode causar efisema pulmonar;
N2(g) + O2(g)  2 NO(g)
2 NO(g)
Reação de formação do óxido nítrico a partir da queima do nitrogênio do ar.
· Em 1998 o Prêmio Nobel de Medicina e Fisiologia foi concedido a três norte-americanos descobridores do princípio de como o óxido nítrico transmite sinais pelo corpo e do papel da substância no controle do sistema circulatório. O NO está envolvido em muitos processos fisiológicos dos mamíferos, que incluem a neurotransmissão, controle da pressão sangüínea, inflamação, reações imunológicas e nos mecanismos de defesa contra microorganisnos e tumores.
FONTE: Ensino Globalizado para todo, Profpc óxidos
Nayara, Thiago, Iziane 2º 4
Nenhum comentário:
Postar um comentário