APLICAÇÕES DOS PRINCIPAIS SAIS DO COTIDIANO
SAL é todo composto iônico capaz de se dissociar na água liberando íons, dos quais pelo menos um cátion é diferente.
Ø Cloreto de sódio – NaCl
· É conhecido como sal marinho, quando o mesmo é extraído, por evaporação, a partir da água do mar, armazenada em grandes tanques, cavados na areia, chamados de salinas.

sal marinho sendo removido das salinas
· O sal marinho é utilizado na alimentação. É um ingrediente indispensável ao organismo humano e animal. O NaCl é um dos constituintes da corrente sanguínea, e dele resulta o ácido clorídrico, existente no suco gástrico.

Sal de cozinha com seu constituinte básico: NaCl
· Por lei é obrigatório a adição de certa quantidade de sais de iodo (NaI e/ou KI) ao NaCl destinado à alimentação, porque a falta de iodo no organismo pode acarretar inflamação da glândula tireóide originando uma doença conhecida como Bócio.
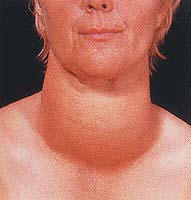
Bócio ou papo (inflamação na glândula tireóide por falta de iodo)
· Em Medicina o NaCl é componente do soro fisiológico (solução aquosa contendo 0,9% de NaCl) utilizado em soros, limpeza de lentes ou no combate a desidratação.

Soro fisiológico (solução aquosa de NaCl 0,9%)
· O NaCl é utilizado na conservação de carnes, pescado e peles. O sal absorve a água que existe no alimento, com isso evita a sobrevivência das bactérias e o apodrecimento da carne.

“Carne de sol” ou “charque” (carne curtida com NaCl e colocada ao sol para facilitar a evaporação da água)
· A solução aquosa de NaCl (salmoura) submetido a eletrólise consiste no processo de obtenção industrial de NaOH (soda cáustica) e também do gás hidrogênio e do gás cloro (Cl2).
Ø Carbonato de sódio – Na2CO3
· É conhecido como barrilha ou soda.

Barrilha ou soda
· Utilizado na fabricação do papel, de sabões e do vidro, e também aplicado no tratamento da água de piscina.

Barrilha ou soda utilizado no tratamento da água de piscina
Ø Fluoreto de sódio – NaF
· Anticárie que entra na composição do creme dental, pois inibe o processo de desmineralização dos dentes, conferindo proteção contra a ação das cáries.

Creme dental contendo NaF
Ø Nitrato de sódio – NaNO3
· É conhecido como Salitre do Chile. Recebe este nome, pois o deserto do Chile é a maior reserva mundial deste sal.

Reservas de NaNO3 na província de Antofagasta no Chile
· É utilizado na fabricação de fertilizante (adubos), de vidros, da pólvora negra (NaNO3 + carvão + enxofre). Também é utilizado como preservativo de alimentos.

Pólvora negra constituída por NaNO3 + carvão + enxofre
Ø Hipoclorito de sódio – NaClO
· É um poderoso agente anti-séptico que entra na composição dos alvejantes domésticos (cândida, Q-Bôa, água sanitária, água de lavadeira).

Água sanitária a base de NaClO
· Utilizado como alvejante (branqueador), algicida e bactericida. É também um excelente desinfetante de baixo custo. Adicionado à água, mata o vibrião da cólera, usado no tratamento da água das piscinas e também na limpeza de hospitais.
Ø Bicarbonato de sódio – NaHCO3
· Utilizado em Medicina como antiácido estomacal (Sonrisal, Sal de Frutas Eno, Alka-Seltzer) pois neutraliza o excesso de ácido clorídrico no suco gástrico.

Antiácido a base de NaHCO3
Observe a reação que ocorre no estômago, quando uma pessoa ingere o antiácido com bicarbonato de sódio:
NaHCO3(s) + HCl(aq) → NaCl(aq) + H2O( ) + CO2(g)
) + CO2(g)
O CO2 liberado é o responsável pela eructação (arroto) produzida.
O antiácido contém, além do bicarbonato de sódio, ácidos orgânicos (ác. tartárico, ác. cítrico entre outros). Na presença de água o NaHCO3 reage com os ácidos, liberando CO2(g), que é o responsável pela efervescência.
NaHCO3(s) + H+(aq) → Na+(aq) + H2O( ) + CO2(g)
) + CO2(g)

NaHCO3 em água causando efervescência provocada pela liberação de CO2(g)
· Utilizado como fermento químico (Pó Royal). A decomposição por aquecimento do NaHCO3 produz CO2(g), responsável pelo crescimento da massa do pão ou do bolo:
2 NaHCO3(S)  Na2CO3(S) + H2O(g) + CO2(g)
Na2CO3(S) + H2O(g) + CO2(g)

Fermento químico a base de bicarbonato de sódio (NaHCO3)
· Utilizado como extintor de incêndio (espuma química). No extintor há NaHCO3e H2SO4 em compartimentos separados. Quando o extintor é acionado o NaHCO3 entra em contato com o H2SO4, com o qual reage produzindo uma espuma, com liberação de CO2(g).
2 NaHCO3(s) + H2SO4(aq) → Na2SO4(aq) + 2 H2O( ) + 2 CO2(g)
) + 2 CO2(g)
Estes extintores não podem ser usados para apagar o fogo em instalações elétricas, porque a espuma é eletrolítica, conduz corrente elétrica e pode eletrocutar o operador.

Extintor de espuma química a base de NaHCO3
· Utilizado em desodorantes. Durante a transpiração uma pessoa elimina ácidos orgânicos (representados por -COOH), responsáveis pelo odor característico do suor. O NaHCO3 do desodorante, neutraliza estes ácidos formando sal que é inodoro.
NaHCO3(s) + -COOH(aq) → -COO‑Na+(s) + H2O( ) + CO2(g)
) + CO2(g)

Desodorante contendo NaHCO3
· Utilizado em creme dental. Quando restos de alimentos não são removidos da cavidade bucal, bactérias promovem a decomposição desta matéria orgânica, formando ácidos orgânicos, tais como o ácido láctico, que são neutralizados pelo NaHCO3, evitando desta forma, a formação da cárie.

Creme dental contendo bicarbonato de sódio
Ø Carbonato de cálcio – CaCO3
· É encontrado na forma de três variedades polimorfas: calcário, mármore ecalcita.
· Na forma de calcário é adicionado ao solo para reduzir a acidez, utilizado na fabricação do vidro e do cimento Portland.
Formação do vidro: barrilha + calcário + areia à vidro
Formação do cimento: calcário + argila + areia à cimento Portland
· Na forma de mármore é utilizado na fabricação de pisos, pias, túmulos, estátuas, escadarias, etc.


Materiais produzidos pelo homem a partir do CaCO3: estátua, pisos e pias.
· Na forma de calcita, entra na composição das conchas, corais, pérolas, estalactites (no teto), estalagmites (no solo), casca-de-ovo, etc.


Materiais produzidos pela natureza que contém CaCO3: conchas, corais e estalactites (teto).
Ø Sulfato de cálcio – CaSO4
· É conhecido como gipsita.
· O CaSO4 anidro é utilizado na fabricação do giz escolar, enquanto o CaSO4hidratado é utilizado na obtenção do gesso.

Giz escolar constituído por CaSO4 anidro
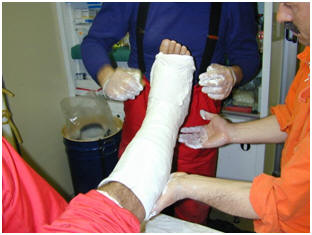

CaSO4 hidratado utilizado como gesso em Medicina e na construção civil como ornamentos de paredes.

CaSO4 hidratado utilizado como gesso na Odontologia na confecção de moldes para dentaduras e pontes.
Ø Sulfato de magnésio – MgSO4
· É conhecido como Sal amargo ou Sal de Epsom.
· Utilizado em Medicina como purgativo ou laxante.

Sulfato de magnésio utilizado em Medicina como laxativo.
Ø Sulfato de bário – BaSO4
· É conhecido popularmente como contraste, pois atua como meio opaco na radiografia gastro-intestinal.
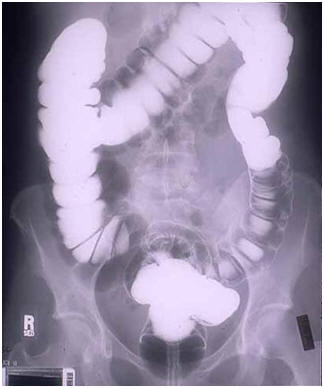
Radiografia de intestino utilizando sulfato de bário
O sulfato de bário constitui o que se chama um agente radiopaco, isto é, opaco aos Raios X e utilizado clinicamente para diagnosticar certas condições patológicas, pois permite realizar radiografias e radioscopias de órgãos moles, que normalmente são transparentes aos Raios X.
Como é insolúvel em água e em gordura, sulfato de bário forma, ao ser misturado com água, uma suspensão densa que bloqueia os Raios X. Em conseqüência, as áreas do corpo em que estiver localizado aparecerão brancas na radiografia.
Isso cria a distinção necessária, ou contraste, entre um órgão e os demais tecidos, ajudando o radiologista a perceber qualquer condição especial existente no órgão ou parte do corpo analisada.
Administrado por via oral ou retal, permite assim exames do trato gastro-intestinal e a detecção de câncer, tumores, úlceras e outras condições inflamatórias como pólipos e hérnias.
Ø Fosfato de cálcio – Ca3(PO4)2
· Encontra-se sob a forma dos minerais fosforita e apatita.
· É um importante componente dos ossos e dos dentes do corpo humano.
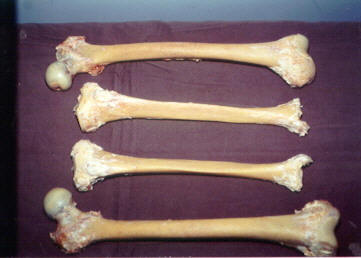
O fosfato de cálcio é responsável pela resistência do osso à tração.
· É utilizado na fabricação de fertilizantes como os superfosfatos ou hiperfosfatos.
· È o principal componente da mistura conhecida como “farinha de osso”, obtida a partir da calcinação de ossos de animais.
FONTE: Ensino Globalizado Educação para Todos, Profpc sais
Nayara, Thiago, Iziane 2º 4
Nenhum comentário:
Postar um comentário